东京热
在SUMO化修饰介导鱼类锌代谢调控中取得新进展
近日,东京热
罗智教授团队在国际著名生物学期刊《Cellular and Molecular Life Sciences》正式发表题为“SENP1 mediates zinc-induced ZnT6 deSUMOylation at Lys-409 involved in the regulation of zinc metabolism in Golgi apparatus”的研究性论文。该研究揭示了锌转运蛋白ZnT6的SUMO化翻译后修饰在鱼类锌代谢调控中的分子机制。
锌是一种重要的微量元素,参与脊椎动物的多种生理过程。然而,过量的锌积累具有细胞毒性,与氧化应激、糖脂代谢失调、免疫功能受损有关。因此,维持适宜的胞内锌水平对于防止过量的潜在毒性至关重要。锌转运蛋白家族SLC30A/ZnTs家族和SLC39A/ZIPs家族与金属硫蛋白(MTs)共同调控细胞锌稳态。锌转运蛋白6(ZnT6)作为ZnT家族的一员,定位于高尔基体,在将锌从细胞质转运到高尔基体中起着关键作用。小泛素相关修饰物(SUMO)化修饰作为一种可逆的翻译后修饰,通过动态调控靶蛋白的稳定性、亚细胞定位和活性来参与多种生理过程。然而,对锌转运蛋白的SUMO修饰的研究仍未得到充分的探索。
为解析SUMO化修饰对锌代谢的潜在调控机制,研究团队以特色经济养殖鱼类—黄颡鱼为研究对象,成功构建体外SUMO化修饰系统。细胞实验证实,ZnT6可以发生SUMO化修饰,且以SUMO1修饰为主。通过免疫共沉淀实验,研究进一步发现ZnT6与E2结合酶UBC9存在相互作用。鉴于SUMO化修饰是动态可逆的过程,研究团队证实去 SUMO 化酶(SENP1)可特异性介导 ZnT6 的去 SUMO 化修饰,且该过程依赖于 SENP1 的保守催化结构域。此外,锌处理及K409R突变均显著降低ZnT6的SUMO化水平,这表明锌介导SUMO1对ZnT6第409位赖氨酸位点的SUMO化修饰水平下调,进而增强SENP1介导的去SUMO化进程。
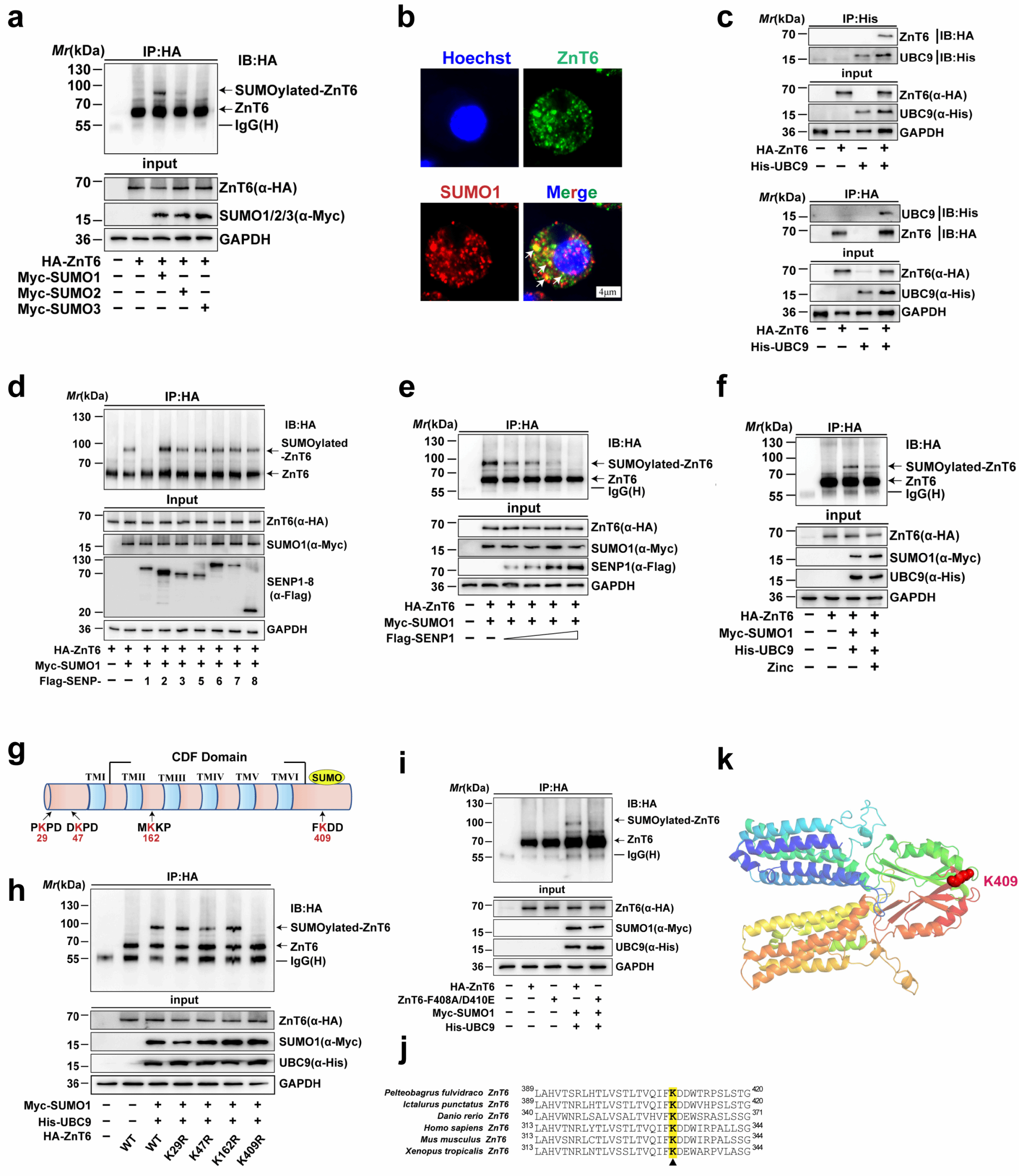
SUMO1介导ZnT6赖氨酸409位的SUMO化修饰
功能分析显示,ZnT6的SUMO化修饰虽未改变其亚细胞定位,但显著降低其蛋白稳定性,导致其蛋白表达被显著抑制。关键机制证实,ZnT6的去SUMO化修饰对其介导锌离子从胞质向高尔基体转运过程具有决定性作用,这一发现为理解锌代谢调控的分子机制提供了新的视角。
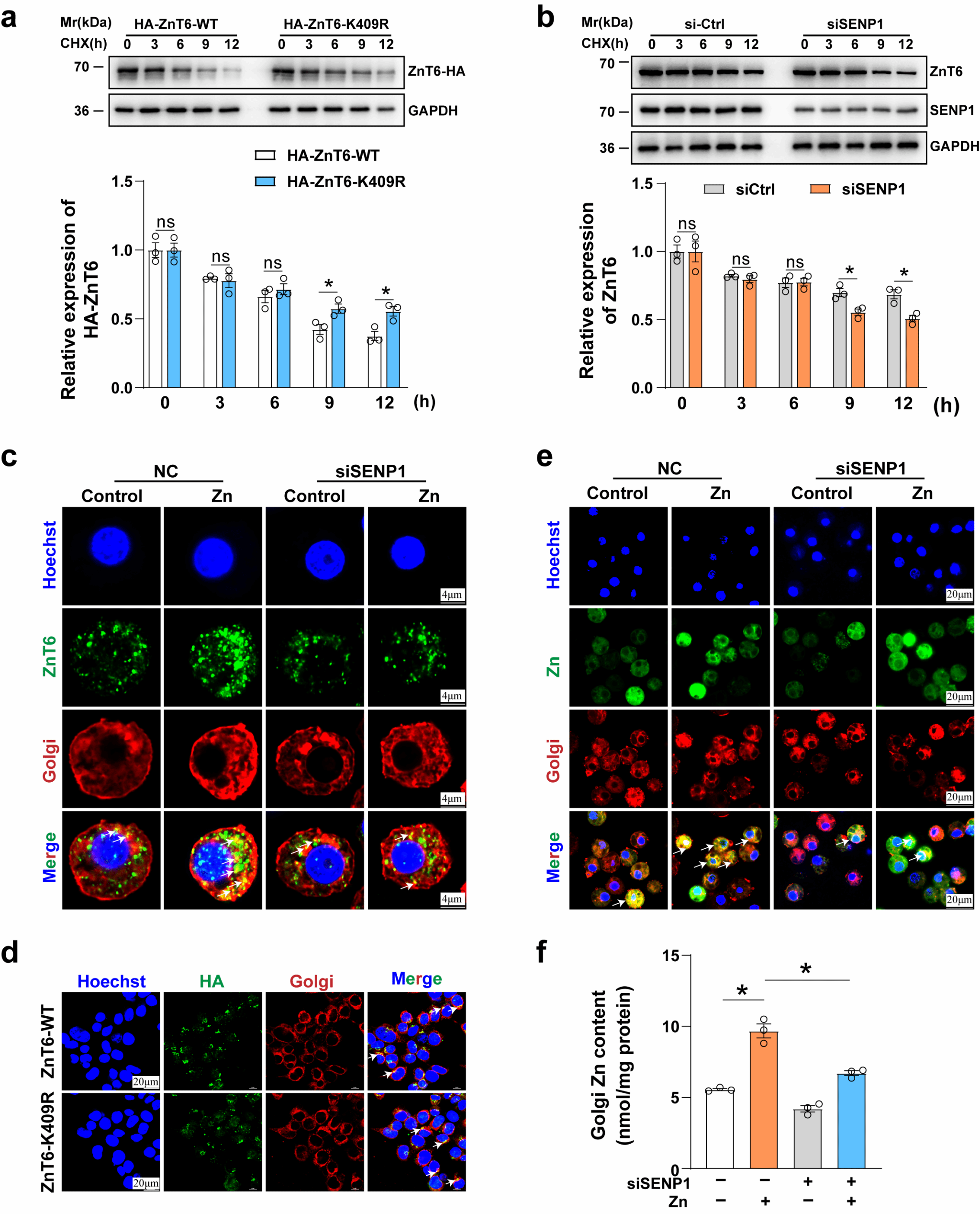
SUMO化修饰对ZnT6蛋白稳定性及亚细胞定位的影响
该研究首次揭示SUMO1催化的SUMO化修饰与SENP1介导的去SUMO化修饰通过动态调控ZnT6功能,协同介导高尔基体内锌代谢稳态的分子机制,不仅完善脊椎动物锌代谢的调控机制,也为锌代谢相关疾病的干预及水产养殖中鱼类健康调控提供了新思路。
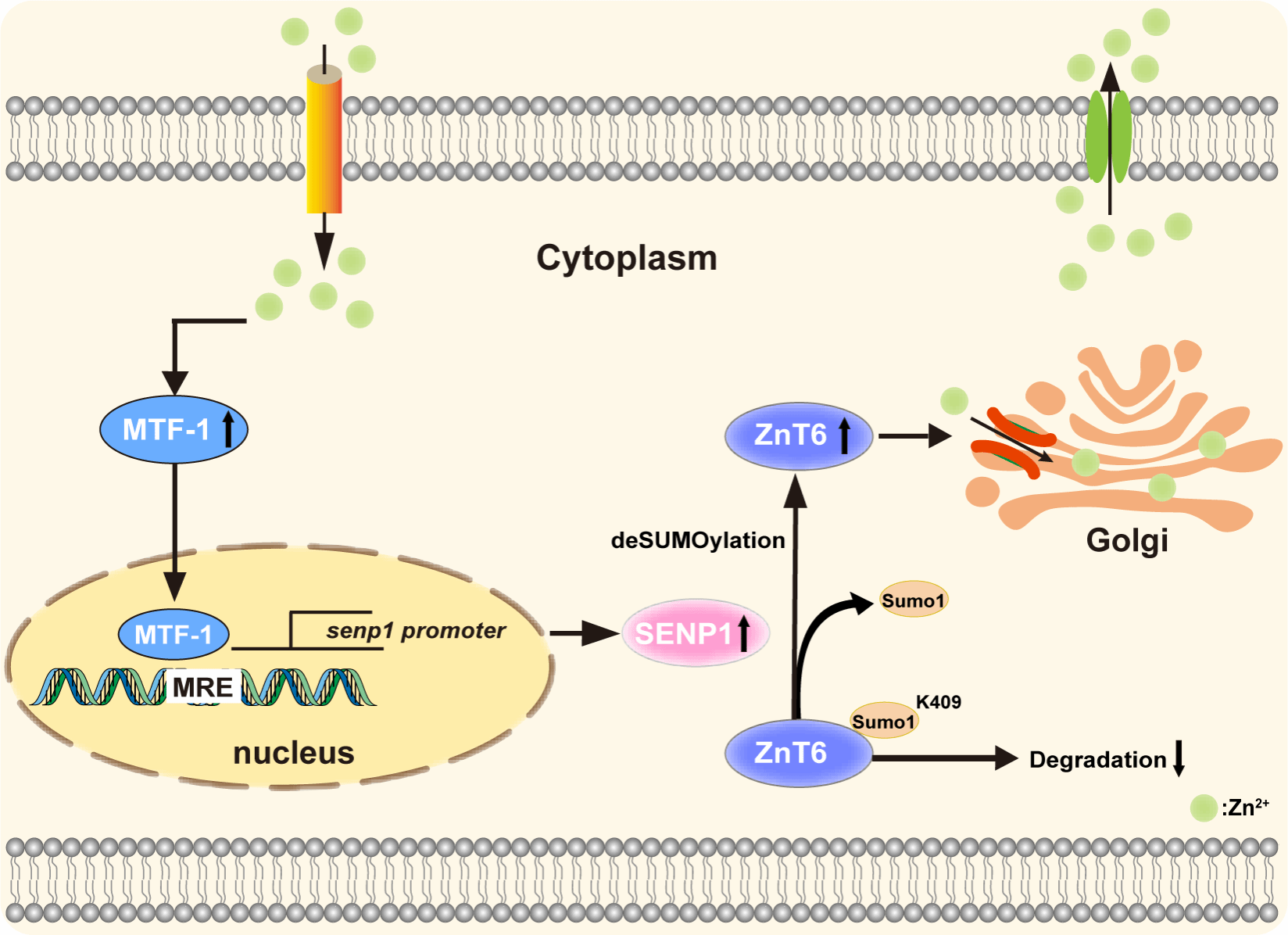
MTF-1/SENP1通路介导的ZnT6 deSUMOylation修饰参与高尔基体锌代谢调节的机制
学院已毕业博士宋长春为第一作者,罗智教授为通讯作者。伦敦国王学院Christer Hogstrand教授指导了该项工作。该研究获得了国家自然科学基金重点项目(32030111)和面上项目(31872585)的支持。